










门静脉高压症是肝病严重并发症之一,其主要原因为肝硬化,也源于多种非肝硬化疾病,如巴德-基亚里综合征、门静脉血栓形成及特发性门静脉高压等,上述门静脉高压常常归类为非硬化性门静脉高压(NCPH)。NCPH本质上因无肝硬化而保持正常肝脏合成功能,根据病变部位分为肝前、肝后及肝内。本文主要围绕肝窦病因阐述NCPH诊断、治疗进展,包括肝窦阻塞综合征(SOS)、特发性非硬化性门静脉高压症、先天性肝纤维化、结节再生性增生等。 1 肝窦阻塞综合征(SOS) 1.1 病因与发病机制 SOS是一种末端肝小静脉闭塞性静脉炎,以肝小血管损伤累及特定肝窦内皮细胞为特征,肝窦损伤与肝小静脉部分或完全闭塞相关联,病情进展导致肝窦流出道阻塞而引起窦性门静脉高压症,故又称肝小静脉闭塞病,其主要致病因素包括造血干细胞移植(HSCT)前化疗预处理、结直肠癌肝转移部分肝切除术前以奥沙利铂为基础的辅助或非辅助化疗、放射性肝病、急性髓性白血病化疗、肝移植、含吡咯双烷生物碱(PA)中草药治疗,常染色体遗传病静脉闭塞病合并免疫缺陷等。国外报道的SOS多与HSCT化疗药物预处理有关,高强度预处理方案包括白消安联合环磷酰胺、环磷酰胺联合放疗(照射量>12 Gy)、环磷酰胺联合卡莫司汀和依托泊苷,或其他类似强度方案;国内SOS报道以口服土三七等含PA中草药最常见,文献系统评价提示比例达66%。含PA植物包括菊科菊三七(即土三七)、千里光、 泽兰、 狗舍草、兰科羊耳蒜、豆科野百合、猪屎豆及紫草科天芥菜、软硬紫草等。肝窦状隙损伤与奥沙利铂为基础的结直肠癌肝转移化疗存在明确相关性,发生率达75%;伊立替康为基础的化疗相关性损伤发生率25%~40%,5-氟尿嘧啶也与窦状隙损伤独立相关。其他SOS相关药物包括6-巯基嘌呤、6-硫鸟嘌呤、放线菌素D、硫唑嘌呤、白消安、阿糖胞苷、环磷酰胺、达卡巴嗪、吉妥珠单抗奥佐米星、美法仑及乌拉坦,但硫唑嘌呤与SOS相关性仍不明确,原因包括剂量关系不明显、已报道使用硫唑嘌呤的疾病克罗恩病、肾移植及肝移植均与窦状隙病变相关。此外,遗传背景可能也与SOS存在关联:乙酰肝素酶单个核苷酸多态性 (rs4693608和rs4364254) 与儿童异基因造血干细胞移植相关SOS,亚甲基四氢叶酸还原酶单体型677CC/1298CC与溴尿嘧啶相关SOS、谷胱甘肽-S-转移酶M1无效等位基因与奥沙利铂相关SOS均存在相关性。 SOS主要病理改变为肝窦状隙内皮细胞毒性损伤,发病机理包括谷胱甘肽及一氧化氮耗竭、肝内基质金属蛋白酶及血管内皮细胞生长因子表达增加;凝血因子激活、氧化应激也可能参与发病, 抗氧化剂有潜在的改善或预防SOS作用。导致SOS的药物均专一通过肝细胞细胞色素P450系统代谢,谷胱甘肽为该系统抗氧化剂解毒机制。肝脏接触相关药物后出现谷胱甘肽耗竭,严重谷胱甘肽耗竭导致窦状隙细胞易于死亡,预防性灌注谷胱甘肽或N-乙酰半胱氨酸则可防止野百合碱大鼠发生SOS,毒性中间产物代谢的物种间差异可能部分解释不同物种对PA的敏感性差异。人组织超微架构观察提示最初形态变化为肝窦阻塞,尔后出现末端肝小静脉闭塞,并在啮齿动物模型中得到证实;喂养PA野百合碱大鼠模型也显示最早病变为肝窦损伤,继而出现纤维化及末端肝小静脉闭塞。野百合碱PA大鼠模型还显示骨髓干细胞修复窦状隙内皮细胞对维护窦状隙结构至关重要,而放射治疗可能因抑制骨髓而损伤窦状隙内皮细胞修复机制。总体而言,由PA和骨髓移植化疗药物预处理诱导的窦状隙病变可能由多种因素导致,包括窦状隙及中央静脉内皮细胞剂量相关性毒性损伤、放疗及药物影响内皮细胞骨髓前体细胞动员修复窦状隙损伤。然而,目前难以确定相关肝细胞损伤是否单纯窦状隙损伤,还是窦状隙损伤合并直接肝细胞毒性。接受化疗的结直肠癌肝转移患者肝窦损伤可能源于类似发病机理,也可能源于不同途径的多种促炎症介质相互作用。 1.2 临床表现 急性期起病急,可有黄疸、右上腹剧痛、肝肿大伴触痛、腹水、不明原因体质量增加,重者出现多器官衰竭,病死率达80%以上;亚急性期表现为持久肝大、反复腹水;慢性期则以门静脉高压症为主,包括食管胃静脉曲张、脾大、血小板减少、腹腔积液等;食管胃静脉曲张出血占所有食管胃静脉曲张出血病例的10%~30%;肺部表现及肝性脑病少见。肝酶通常正常或轻微升高,绝大多数患者肝脏合成功能正常,但极少数也可出现严重损伤。 依据胆红素、基线参数、临床进展速度等指标严重程度,将SOS分为3级(表1)。 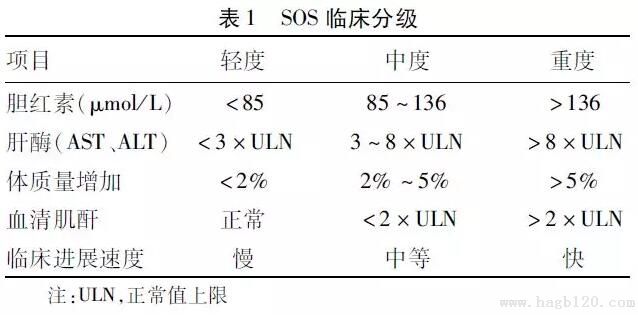 1.3.1 诊断 1.3.1.1 实验室检测 少数患者可有肝功能、凝血功能异常;血清、腹水糖链抗原12-5均可升高;超高效液相色谱-质谱技术检测的血液吡咯-蛋白质加合物为诊断和预后指标,其浓度与PA所致SOS严重程度及临床转归相关;凝血参数蛋白C和抗凝血酶降低,纤溶酶原激活物抑制剂1早期即可升高,被认为是HSCT相关SOS的诊断标志,可预测SOS严重性。基因多态性、铁蛋白、L-Ficolin、透明质酸和血管细胞黏附分子1都可能作为诊断生物标记,但尚存争议,未广泛临床应用。 1.3.1.2 影像学 B超检查不具有高度特异性,联合临床诊断标准对疾病危险分层、严重程度分级及治疗反应评估有益:早期超声检查可无特征性表现,病情进展可出现肝静脉及其分支声像改变,较特异表现包括肝静脉变细或逆向血流、门静脉异常波形、肝动脉阻力指数升高等形态学变化。 CT诊断价值较高,平扫可见肝肿大、密度减低、腹水,增强扫描可见肝动脉增粗扭曲、肝脏轻度不均匀强化,门静脉期可见“地图状”改变、肝静脉显示不清、下腔静脉肝段明显变细、下腔静脉、门静脉周围“晕征”或“轨道征”,延迟期肝内仍可见斑片影及地图样低密度区。CT低密度区与活组织病理检查肝实质坏死区一致。 肝活组织学检查为诊断金标准,优先选择经颈静脉肝活组织检查 。肝静脉压力梯度检测结合组织学检查有助于确定肝窦前、肝窦、肝窦后疾病,但SOS可为局灶性病变,肝活组织检查未必发现病理学诊断特征: (1)急性期:明显中央小叶淤血、肝细胞坏死及含铁血黄素巨噬细胞聚集,末端肝小静脉内膜水肿但无纤维素沉积或血栓形成,细胞环绕窦状隙壁并剥蚀,下游栓塞而导致窦状隙阻塞;红细胞剥离入Disse腔,末端肝静脉下游细胞碎片聚集,窦周星状细胞、内皮下成纤维细胞增殖伴细胞外基质沉积。 (2)亚急性期:HE染色可见中央小叶明显充血,难以发现末端肝静脉者行结缔组织染色以排除SOS。 (3)慢性期:肝小静脉周围密集纤维化呈放射状延伸进入肝实质,疤痕组织包含黄铁血黄素巨噬细胞,末端肝小静脉腔消失,几乎无淤血表现,可有严重肝小叶实质结构破坏,罕见肝硬化形成。 诊断标准包括Seattle及Baltimore标准,前者要求干细胞移植后20 d内有胆红素血症≥34 μmol/L、肝肿大伴右上腹疼痛、腹水或体质量增加超过2%中的2条或以上,后者要求干细胞移植后21 d内胆红素≥34 μmol/L并伴至少2项以下表现:肝肿大疼痛、体质量增加超过5%或腹水。 1.3.2 鉴别 需和肝硬化所致门静脉高压症鉴别,排除其他已知病因,包括移植物抗宿主病及其他静脉流出道阻塞疾病:巴德-基亚里综合征(中央静脉淤血,可能肝实质破坏,但无末端肝小静脉阻塞)、充血性心力衰竭、药物毒性(可有肝细胞凋亡损伤、胆汁淤积、肝实质炎症)。多普勒超声及CT检查可排除静脉血栓形成、心包填塞、缩窄性心包炎、巴德-基亚里综合征及肝内占位病变。 1.4 治疗 尚无确切特异性病因治疗,积极寻找并消除可疑病因。 1.4.1 急性期 主要是对症、支持治疗,包括输液管理、给氧、输血等最大限度减少缺氧性肝损伤,同时补充熊去氧胆酸、谷胱甘肽,避免肝、肾毒性反应;轻度患者可观察,中度患者考虑利尿治疗缓解体液负荷、同时保留有效肾脏血流,防止肾前性氮质血症及潜在肝肾综合征;腹水应考虑必要的腹腔穿刺放腹水治疗,放腹水应适度,一般1 L/d,以免损害肾脏血供;严重病例需要肾替代疗法等其他治疗。肝移植仅适应于严重肝衰竭患者期望无肝病生存及良性疾病行骨髓移植患者;恶性疾病为禁忌证。 潜在特异性治疗药物包括: (1)去纤苷,美国及欧洲唯一批准治疗药物,是一种多聚脱氧核糖核苷酸,具有抗血栓、抗炎性反应、抗缺血特性,通过多种机制保护肝脏微脉管系统,包括腺苷A1、A2受体激动剂作用减少腺苷分子表达而阻止炎症介质出现、防止窦状隙狭窄,减少纤维蛋白溶解酶原活化抑制剂1、提高组织纤维蛋白溶解酶原活化剂水平提高溶解纤维蛋白活性。此外,去纤苷还刺激前列腺素I2、E2产生而扩张血管,抑制血小板聚集,活化溶解纤维蛋白系统。迄今临床试验显示为最有前景药物,已在33个国家超过240个移植中心应用。大量临床试验显示其可改善完全应答率及生存率,完全缓解率42%,超过1800例患者总体治疗显示明显耐受性及安全性。 (2)组织纤维蛋白溶解酶原活化剂,用于抗凝及溶血栓治疗,有效率约29%,出血风险达88%,尤其是中、重度患者,致命性出血常见,无明显生存获益。近年小样本研究提示不联合抗凝剂治疗中度患者有效率80%以上,5年生存率49%;低剂量(≤10 mg/d)治疗重度患者有效率低至33.3%。 (3)甲泼尼龙,在警示并发感染前提下使用,治疗10 d内降低胆红素水平50%以上。 (4)其他药物,非硬化性及肝硬化门静脉高压动物模型研究显示法尼醇X受体(FXR)激动剂可减轻非硬化性及非酒精性脂肪性肝炎肝纤维化。模拟肝硬化门静脉高压及NCPH大鼠模型研究显示FXR激动剂PX20606及甾体类激动剂奥贝胆酸通过诱导窦状隙血管扩张、肝内血管收缩、抑制窦状隙重建、减少纤维化而明显降低门静脉压力。 1.4.2 慢性期 可选择门-体或门-肺分流术,经颈静脉肝内门体分流术(TIPS)可减轻门静脉压力、缓解腹水,但一些病例未必改善预后;肝衰竭及治疗无效慢性患者需考虑肝移植。胃镜下套扎与普萘洛尔一级、二级预防食管胃静脉曲张出血效果相似。反复静脉曲张出血或顽固性腹水患者需考虑肝移植治疗,5年生存率94%,但存在疾病复发风险。 1.5 预防与预后 高危人群为有基础肝病及全身炎症患者,包括病毒性肝炎、酒精性肝炎、非酒精性脂肪肝及其他肝酶升高病因;HSCT患者包括接受高剂量全身放疗、环磷酰胺、白消安及其他肝毒性药物治疗。预防措施包括减少术前放疗强度、移植前2周开始熊去氧胆酸治疗,但循证医学证据不明确;奥沙利铂为基础化疗方案中加入贝伐珠单抗对抗血管内皮细胞生长因子;尽管前瞻性对照研究提示高危儿童患者可考虑去纤苷预防性治疗,但目前未获得批准用于预防性治疗。 SOS病死率20%~50%,预后取决于肝损伤及肝功能不全程度,楔形肝静脉压力梯度超过20 mm患者预后不良。 2 特发性非硬化性门静脉高压 一组病因未明的血管性肝病,理论上将病因分为慢性感染、血栓形成、遗传性疾病、药物或毒素及免疫性疾病五类。病理生理学机制推测包括:首次打击造成脾窦扩张导致脾大、继而门静脉血流增加导致门静脉高压,该理论缺陷在于正常肝脏允许门静脉血流明显增加而门静脉压力正常或仅轻微增加;另一理论认为肝内血管床损伤而继发肝内门静脉阻力增加。临床表现视是否存在门静脉高压症而异:无门静脉高压症体征但有类似组织学改变、有门静脉高压体征[血小板减少、脾大和(或)食管胃静脉曲张]但无症状、有门静脉高压并发症(主要是静脉曲张出血)。约70%患者发病时有食管胃静脉曲张,其中1/3以食管静脉曲张出血为首发表现;脾肿大发生率高,肿大程度高于肝硬化或门静脉血栓形成。实验室检查可发现肝功能无受损,多数肝功能不全源于其他疾病并发症;贫血、粒细胞减少、血小板减少常见;明显肝性脑病少见,轻微肝性脑病约7%~8%,其中超过70%存在大门静脉-体循环分流;肝肺综合征罕见但可发生;门静脉血栓形成5年发生率30%~40%,主要发生于静脉曲张出血史或HIV感染者。尽管少见,一些患者仍可进展为肝衰竭和(或)顽固性门静脉高压并发症。诊断上尚无特异性检查,通常根据存在门静脉高压症表现但排除其他可能肝病或已知病因而诊断(表2)。确定诊断需依靠肝活组织检查,同时排除血吸虫感染、先天性肝纤维化及其他肝病,组织病理学特征包括汇管区及窦周病变、肝小叶病变及肝血管病变。  在治疗方面:治疗相关性疾病,停用可能相关性药物。门静脉高压及其并发症治疗参照肝硬化门静脉高压。不建议预防性抗凝治疗。TIPS治疗食管胃静脉曲张出血、腹水等严重和(或)顽固性门静脉高压并发症效果良好,但伴随其他严重疾病及肾衰竭(血清肌酐>100 mol/L)者预后不良。肝移植指征同其他肝病。 在预后方面:有临床门静脉高压表现者10年病死率56%~82%,出现腹水或伴免疫性疾病、恶性疾病者预后不佳。 3 先天性肝纤维化 一种少见常染色体隐性遗传性先天性胆管上皮细胞疾病,以类似导管板畸形胆管改变及进展性非炎症性胆管周围纤维化为特征,与PKHD1基因变异有关,该基因编码纤毛样蛋白纤维胱氨酸表达于胆管细胞。发病机制未明确,蛋白激酶A依赖pSer675-β-连环蛋白信号缺失、纤维胱氨酸缺失(PKHD1del4/del4)的胆管上皮细胞募集巨噬细胞促进汇管区纤维化、β-连环蛋白及白介素1β依赖趋化因子(C-X-C基序)配体10均可能与疾病进展有关。小鼠模型显示上皮细胞功能不全导致轻微炎症、巨噬细胞聚集及胶原沉积而发生纤维化。肝内门静脉异常分支及汇管区进展性纤维化为病理学特征。临床以继发性门静脉高压症为主,包括呕血、黑便、腹部包块、肝脾区不适或胀痛、贫血、反复发热,部分患者合并Caroli病(先天性肝内胆管扩张) 而反复上腹痛、发热、黄疸,合并多囊肾者最终出现尿毒症症状。50%患者因消化道大出血死亡。尽管肝肿大而质地坚硬,但肝功能代偿良好。门静脉高压常导致脾肿大、脾功能亢进、食管胃静脉曲张;腹水、门肺高压及肝肺综合征少见,但常伴肝肾纤维囊性病变,一般不发生肝性脑病及肝衰竭。 典型诊断为超声检查或磁共振胆管胰腺造影检查发现胆管扩张、肝左叶肿大及脾肿大,伴或不伴肝肾囊肿。 先天性肝维化无根治性方法,以对症治疗为主,门静脉高压主要依靠内镜治疗,偶需外科手术;终末期先天性肾病患者需考虑肾移植或肝肾联合移植。合并肝内胆汁淤积、败血症、食管静脉曲张出血或肾盂肾炎、肾性高血压、肾衰竭等肾病时严重影响预后。 4 结节再生性增生 结节再生性增生占病因不明肝酶异常行肝活组织检查患者15%。化疗药、免疫抑制剂及血液、免疫、炎症及肿瘤性疾病均与之相关,发病机制似乎与肝细胞适应性增生反应有关。病理上,肝实质部分或全部转化为再生性小结节(1~3 mm), 一些融合形成大结节,结节之间无纤维间隔的特征可区别于肝硬化,结节中心肝细胞肥大,而周边萎缩;血流动力学表现为窦周门静脉高压,75%病例低于12 mm Hg,而门静脉压力较高。大部分患者无症状,有症状者表现为门静脉高压体征,而肝功能代偿。影像学无特异性表现,超声表现为边缘透亮的低回声或等回声结节,增强CT则显示动脉相与门静脉相均为等密度或低密度,增强磁共振T1加权像呈高密度信号及及T2加权像呈等密度、低密度信号, 组织学表现为弥漫性微小结节但无纤维间隔。临床诊断主要依靠组织病理学诊断,但不同阅片者诊断一致性较差。治疗主要针对原发病,门静脉高压主要为内镜治疗、外科分流或TIPS,肝移植病例罕见。预后取决于潜在相关疾病,与门静脉高压及静脉曲张程度无关。 引证本文:陈永鹏. 肝硬化以外窦性门静脉高压症的诊断与治疗[J]. 临床肝胆病杂志, 2019, 35(1): 18-23. |